NaHCO3 có lưỡng tính không? ĐẦY ĐỦ NHẤT về hợp chất NaHCO3
NaHCO3 có lưỡng tính không? NaHCO3 có tan trong nước không? Tính chất hóa học của NaHCO3 như thế nào? Tất tần tật thông tin về hợp chất NaHCO3 sẽ được Minchico chia sẻ dưới đây. Mời bạn đọc tham khảo, tìm hiểu nhé!

Mục lục
NaHCO3 là chất gì?
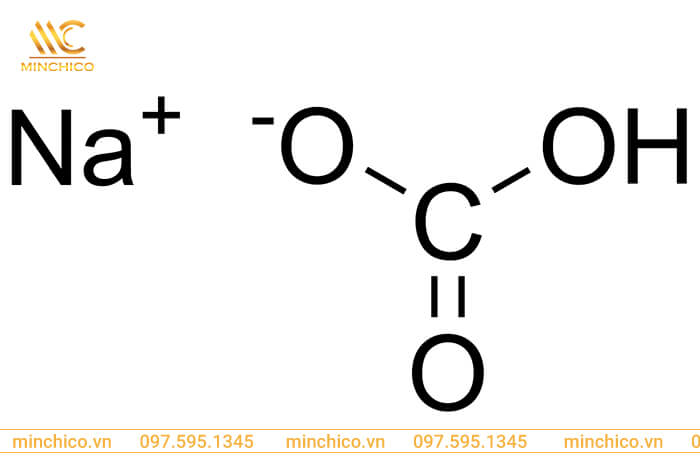
Natri hydrocacbonat có công thức hóa học là NaHCO3. NaHCO3 là một dạng muối tinh thể được tìm thấy ở dạng khoáng chất tự nhiên trong các mỏ nahcolit. Chất này bao gồm một cation natri (Na +) và một anion bicacbonat (HCO 3 –).
NaHCO3 có các tên gọi khác là: Natri Biocacbonat, bicacbonat soda, muối nở, baking soda, Sodium bicarbonate.
NaHCO3 có lưỡng tính không?
Chất lưỡng tính là gì?
Trong hóa học, hợp chất lưỡng tính là một phân tử hoặc ion có thể phản ứng với cả axit và bazo. Cụ thể, nó sẽ hoạt động như một axit khi có mặt của bazơ. Và hoạt động như một bazơ khi có mặt axit.
Một hợp chất lưỡng tính sẽ có một hidro (proton) có thể chuyển giao và một nguyên tử có các cặp electron riêng lẻ.
Các xác định hợp chất lưỡng tính đơn giản nhất là tìm ra khả năng cộng và khử ion hidro của các phân tử khác.
Vậy NaHCO3 có lưỡng tính không?
NaHCO3 là hợp chất lưỡng tính. Bởi vì NaHCO3 có khả năng cho Proton khi tác dụng với bazơ (thể hiện tính axit). Đồng thời hợp chất này cũng có khả năng nhận Proton khi tác dụng với axit (thể hiện tính bazo).
Phương trình phản ứng hóa học điển hình:
Tác dụng với bazơ mạnh NaOH: NaHCO3 + NaOH → Na2CO3 + H2O
Tác dụng với axit mạnh HCl: NaHCO3 + HCl → NaCl + CO2+ H2O
NaHCO3 có phải là muối axit không?
NaHCO3 là muối axit. Bởi vì chất này có chứa nguyên tử hidro (H) linh động trong các thành phần gốc axit. Nó có thể tiếp tục phản ứng với dung dịch kiềm. Đó chính là tính chất axit yếu của NaHCO3.
Tuy nhiên, NaHCO3 chỉ là muối của axit yếu. Vì thế, nó vẫn có thể tác dụng với các axit mạnh như H2SO4, HCl… thể hiện tính bazo. Đây cũng là lý giải hợp lý cho câu hỏi NaHCO3 có lưỡng tính không.
Dung dịch NaHCO3 có môi trường gì?
Dung dịch natri hydrocarbonat là môi trường bazơ yếu. Vì vậy mà trong y học, chất này được sử dụng phổ biến để trung hòa axit trong dạ dày.
Tính chất vật lý của NaHCO3
NaHCO3 tồn tại ở thể rắn, màu trắng, dạng tinh thể, không mùi. Nhưng thường thấy chất này ở dạng bột mịn. NaHCO3 là muối nên có vị hơi mặn đắng, tính kiềm giống như Natri cacbonat. Độ pH của dung dịch nước 0,1 mol NaHCO3 mới chuẩn bị là 8,3.
Tham khảo bảng tính chất vật lý đầy đủ của NaHCO3:
| Công thức phân tử | NaHCO3 |
| Khối lượng mol | 84,00614 g/mol |
| Màu sắc | Chất rắn kết tinh màu trắng |
| Khối lượng riêng | 2,159 g/cm³, rắn |
| Nhiệt độ nóng chảy | 50 °C (323 K; 122 °F) (phân hủy) |
| Độ hòa tan trong nước | nước 7,8 g/100 mL (18 ℃) |

Tính chất hóa học của NaHCO3
NaHCO3 là hợp chất lưỡng tính. Hợp chất này không tan trong etanol và ít tan trong metanol và axeton. Nó có những tính chất hóa học như sau:
Nhiệt phân
NaHCO3 nhiệt phân ở nhiệt độ 80–100 ° C tạo muối, nước và giải phóng CO2. Quá trình này sẽ diễn ra nhanh hơn nếu nhiệt độ tăng lên đến 200°C.
Phản ứng hóa học nhiệt phân: 2 NaHCO 3 → Na 2 CO 3 + H 2 O + CO 2
Thủy phân
NaHCO3 có tan trong nước không? NaHCO3 tan hoàn toàn trong nước và không có kết tủa. Phản ứng thủy phân này sẽ sinh ra môi trường bazơ yếu, làm cho quỳ tím đổi màu.
Phương trình phản ứng: NaHCO3 + H2O → NaOH + H2CO3
Tác dụng với axit mạnh
NaHCO3 có thể tác dụng với axit mạnh tạo ra muối và axit cacbonic. Sau đó chất thu được dễ dàng bị phân hủy thành cacbon dioxit và nước.
Phương trình phản ứng:
- NaHCO 3 + HCl → NaCl + H 2 CO 3 => H 2 CO 3 → H 2 O + CO 2
- 2NaHCO3 + H2Co3 → Na2Co3 + 2H2O + 2CO2
- 3NaHCO3 + H3PO4 → 3CO2 + 3H2O + Na3PO4
- 2NaHCO3 + H2SO4 → Na2SO4 + 2CO2 + 2H2O

Tác dụng với bazơ
NaHCO3 tác dụng với bazơ, phương trình phản ứng tạo ra 1 hoặc 2 muối mới và bazo mới.
Ví dụ các phương trình phản ứng:
- 2NaHCO3 + 2Cu(OH)2 → Cu2(OH)2CO3 + Na2CO3 + 2H2O
- Mg(OH)2 + 2NaHCO3 → Mg(HCO3)2 + 2NaOH
- Ca(OH)2 + NaHCO3 → CaCO3 ↓ + H2O + NaOH (Phản ứng có thể tạo ra 2 muối mới).
Sở hữu đội ngũ kỹ thuật viên lành nghề, giàu kinh nghiệm với giải pháp công nghệ lắp đặt thông minh, hiện đại, Minchico tự hào mang đến dịch vụ thiết kế thi công bể bơi trọn gói tối ưu nhất cho mọi nhà. Liên hệ ngay 0975951345
Ứng dụng NaHCO3 là gì?
Trung hòa axit trong phòng thí nghiệm
NaHCO3 là chất lưỡng tính. Nó được sử dụng để phản ứng với axit, giải phóng CO2. Có thể sử dụng chất này để thực hiện trung hòa axit không mong muốn hoặc axit trong phòng thí nghiệm hóa học. Tuy nhiên, NaHCO3 không thích hợp sử dụng để trung hòa bazơ.
Trong ngành thực phẩm
Một trong những ứng dụng phổ biến nhất của NaHCO3 là chế biến món ăn. Baking soda được sử dụng như một chất tạo men trong các món nướng. Men hóa học đòi hỏi chất xúc tác có tính axit trong bột. Khi tiếp xúc với NaHCO3, sẽ sinh ra phản ứng axit – bazo đơn giản, giải phóng carbon dioxide.
Ngoài ra, baking soda cũng có thể giải phóng một lượng nhỏ khí cacbonic thông qua quá trình nhiệt phân ở nhiệt độ trên 50 độ C mà không cần axit đơn giản. Điều này sẽ làm thay đổi độ đặc và kết cấu của món ăn.
Trong sản xuất trái cây, NaHCO3 tỏ ra hữu hiệu trong việc loại bỏ thuốc trừ sâu bám trên bề mặt táo so với các chất khử trùng thương mại. Điều này diễn ra là do sự phân hủy hóa học của thuốc trừ sâu khi tiếp xúc với muối natri bicacbonat.

Sản xuất bột nở
NaHCO3 là một thành phần quan trọng để sản xuất bột nở. Chất này có tính kiềm nên tránh được vị kim loại khi có sự thay đổi hóa học trong quá trình nướng bánh. Đồng thời giúp món bánh nở đều, đẹp mắt.
Sản xuất pháo hoa
NaHCO3 là một trong những thành phần chính được sử dụng để sản xuất pháo hoa thông thường. Hiệu ứng xảy ra ro sự phân hủy nhiệt tạo thành khí carbon dioxide, từ đó tạo ra loại tro dài.
Chất khử trùng nhẹ
Baking soda có tính khử trùng yếu. Do đó nó có thể dùng để tiêu diệt nấm mốc, chống lại một số loại virus, vi khuẩn, vi sinh vật. Khi tham gia khử trùng, Baking soda sẽ hấp thụ mùi mốc.

Là sản phẩm chữa cháy
NaHCO3 có thể dùng để dập tắt đám cháy dầu mỡ hoặc cháy điện. Xử lý bằng cách ném chất này vào ngọn lửa. NaHCO3 nhiệt phân giải phòng cacbonic.
Lưu ý trường hợp này không áp dụng trong bếp chiên nhúng nhiều dầu mỡ. Vì khi khí Cacbonic thoát ra lượng lớn có thể làm cho dầu mỡ bắn tung tóe, gây bỏng nặng.
Ngành công nghiệp
NaHCO3 tiếp tục được nghiên cứu để ứng dụng làm sạch quy mô lớn ở các nhà máy nhiệt điện than và khu công nghiệp khác. NaHCO3 có tác dụng như một giải pháp hiệu quả và tiết kiệm để trung hòa khí thải. Đồng thời, giảm lượng khí thải tạo ra sản phẩm khi xuất bán trên thị trường.
Ngành y tế
NaHCO3 được dùng giống như một loại thuốc kháng axit, dùng để điều trị chứng khó tiêu, ợ chua do dạ dày chứa nhiều axit. Phản ứng hóa học trong dạ dày là:
NaHCO 3 + HCl → NaCl + H 2 O + CO 2
Trước khi phẫu thuật đường tiêu hóa, nhuận tràng, NaHCO3 được dùng như PegLyte hòa tan trong nước và uống để rửa đường tiêu hóa và nhuận tràng hiệu quả trước khi phẫu thuật, nội soi. NaHCO3 cũng được thêm vào thuốc gây tê cục bộ. Sử dụng với vai trò ức chế tốc độ mất xương.
Natri hydro cacbonat có nguy hiểm không?
Mặc dù natri hydro cacbonat được coi là chất tương đối an toàn và được sử dụng phổ biến trong y học, thực phẩm. Song, nó vẫn có thể gây hại cho cơ thể khi tiếp xúc với một lượng lớn. Ví dụ như các trường hợp sau:
- Hít phải bột mịn NaHCO3 liều lượng quá cao dẫn đến ho, hắt hơi
- Ăn phải một lượng NaHCO3 lớn có thể gây kích ứng đường tiêu hóa, kích ứng mũi, họng, ngực, rối loạn tiêu hóa. Nặng hơn có thể dẫn đến vỡ dạ dày, nhiễm kiềm toàn thân, phù nề và giãn nở thể tích dịch ngoại bào.
- NaHCO3 tiếp xúc với mắt gây kích ứng nhẹ như đau, đỏ
Như vậy, người tiếp xúc vẫn cần mang đủ kính, mũ, áo, găng tay khi tiếp xúc với NaHCO3. Trường hợp nghiêm trọng (uống phải) nên đưa ngay đến cơ sở y tế gần nhất để xử lý.

NaHCO3 có lưỡng tính không? Trên đây là câu trả lời và toàn bộ thông tin về hợp chất NaHCO3 Natri hidrocacbonat. Hy vọng bài viết sẽ cung cấp cho bạn những kiến thức quan trọng về chất này và có phương án sử dụng đúng đắn, an toàn nhất.

Mãn nhãn với 50+ Mẫu bể bơi vô cực đẹp hút mắt, view chân trời

Tổng hợp những mẫu mái che bể bơi đẹp, chi phí tốt nhất 2022

Tất tần tật thông tin về thủ tục đăng ký kinh doanh hồ bơi 2022